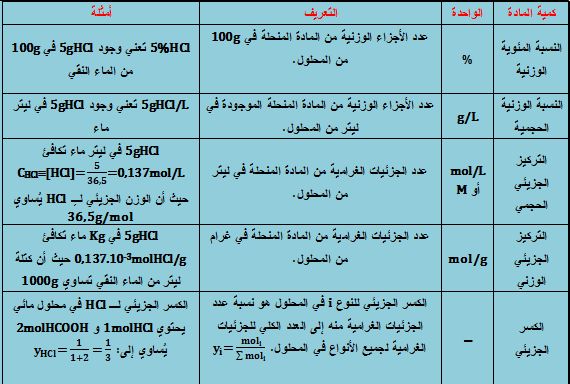
بحث عن تركيز المحلول

3 طرق للتعبير عن تركيز.
بحث عن تركيز المحلول. ونستطيع أن نعبر عن نسبة تركيز المحلول من خلال الوسائل التالية. 3 طرق للتعبير عن تركيز المحاليل. طرق التعبير عن تركيز المحلول. أن تكون المادة المذيبة أعلى من المادة المذابة من حيث الكمية.
التركيز كمية المذاب حجم المحلول. كمية المادة المذابة ب الجرام حجم السائل المذيب ملحوظة. بحث عن تركيز المحلول. يعبر عن العلاقة بين كمية المذاب و حجم المحلول.
المحلول الغازي وينتج عن اختلاط الغازات فالهواء مثلا هو محلول غازي حيث أنه يتكون من مزيج من النيتروجين والأكسجين مع كميات ضئيلة من. عند التطرق للبحث عن تركيز المحلول فلا بد من الاطلاع على تركيز المحلول فذلك المصطلح يشير إلى تركيز المادة المذابة في المذيب أو بمعنى آخر إلى كمية المذاب مقارنة بالمذيب. ان الاذابة الذائبية تحت ظروف معينة من الضغط و الحرارة و ما هي الا تركيز المحلول. هي عبارة عن حجم المذاب في مئة مللتر من المحلول فمحلول مائي تركيزه مثلا 3 حجما هذا يعني أن حجم المذاب يساوي 3 مللتر مذابة في 100 مللتر من المحلول من خلال التطبيق التالي.
وتتميز هذه الجزيئات بخاصية تجعلها تختلف عن المحلول وهي ما يسمى ب tyndall. يعرف التركيز الوزني أو تركيز الكتلة كالآتي. بحث عن تركيز المحلول. بحث عن المحاليل.
بحث عن الكيمياء والمادة. بحث عن المحاليل في الكيمياء المحلول هو مزيج متجانس من مادتين نقيتين أو أكثر وتنقسم إلى محاليل متجانسة ومحاليل غير متجانسة لا يمكن عزلهما عن بعضهما البعض بأي بحث مقال جاهز. أن يكون للمادة المذيبة تأثير فعال. المحلول في الكيمياء هو خليط من المذاب والمذيب بينما التركيز هو مقياس لكمية المذاب التي أذيبت في المذيب.
لكي يتم الحصول على المحاليل فلا بد من توافر مجموعة من الشروط وهي. المحلول الغازي وينتج عن اختلاط الغازات فالهواء مثلا هو محلول غازي حيث أنه يتكون من مزيج من النيتروجين والأكسجين مع كميات ضئيلة من الأرجون.